химэко
Меню сайта
Категории каталога
| 8 класс [27] |
| 9 класс [16] |
| 10 класс [30] |
| 11 класс [5] |
| Экзамен [4] |
| Лаборатория [7] |
| Опорные конспекты [0] |
| Переменка [6] |
| НОТ школьника [9] |
| Решение задач [9] |
| Творческие работы учащихся [3] |
|
Учебные пособия [5]
Электронные копии учебников и дидактики
|
Поиск
Друзья сайта
Наш опрос
Вы нашли на сайте то, что вас заинтересовало?
1. Нашел все, что хотел
2. Нашел, но не все
3. Не нашел ничего интересного
4. Нашел другой интересный материал
Всего ответов: 66
Статистика
Онлайн всего: 1
Гостей: 1
Пользователей: 0

Классная комната
| Главная » Файлы » Уроки химии » 8 класс |
Общие представления о кислотах.
| [ ] | 18.04.2009, 17:38 | ||||
Слова “кислота” и “кислый” не зря имеют общий корень. Растворы всех кислот на вкус кислые. Это не означает, что раствор любой кислоты можно пробовать на язык - среди них встречаются очень едкие и даже ядовитые. Но такие кислоты как уксусная (содержится в столовом уксусе), яблочная, лимонная, аскорбиновая (витамин С), щавелевая и некоторые другие (эти кислоты содержатся в растениях) хорошо знакомы вам именно своим кислым вкусом.
В древности уксус был единственной пищевой кислотой, его название происходит от греческого «оксос», что в переводе означает «кислый». Уксусом как пищевой приправой люди стали пользоваться около трех тысяч лет тому назад, а со временем стали добавлять и другие кислые вещества, например лимонную кислоту. Ее впервые выделил из сока недозрелых лимонов аптекарь Шееле в 1784 году. Структуру и состав органических кислот в то время химики определять еще не могли, поэтому называли полученные вещества по тем исходным материалам, из которых они были получены. Карл Шееле открыл молочную, яблочную, винную (в винограде) кислоты. А вот неорганические кислоты долгое время не связывали с кислым вкусом, и их названия звучали по-другому: «купоросное масло» или «купоросный спирт» - серная кислота, «соляный спирт», «кислый спирт» - хлороводородная кислота, «селитряная дымистая водка» или «крепкая водка» - азотная кислота, смесь азотной и хлороводородной кислоты называли «царская водка». Названия эти пришли из алхимического языка и тоже не отражали особенностей строения кислот. В 1778 французский химик Антуан Лавуазье предположил, что кислотные свойства обусловлены наличием в молекуле атомов кислорода. Эта гипотеза быстро доказала свою несостоятельность, т. к. многие кислоты не имеют в своём составе кислорода, в то время как многие кислородсодержащие соединения не проявляют кислотных свойств. Все кислоты, независимо от их происхождения, объединяет общее свойство - они содержат реакционноспособные атомы водорода. В 1839 немецкий химик Юстус Либих дал такое определение кислотам: кислота — это водородосодержащее соединение, водород которого может быть замещён на металл с образованием соли. В 1887 году шведский физик и химик Сванте Аррениус предпринял попытку создать общую теорию кислот и оснований. Согласно его теории, кислота — это соединение, которое диссоциирует в водном растворе с образованием протонов (ионов водорода H+). Теория Аррениуса быстро показала свою ограниченность, она не могла объяснить многих экспериментальных фактов. 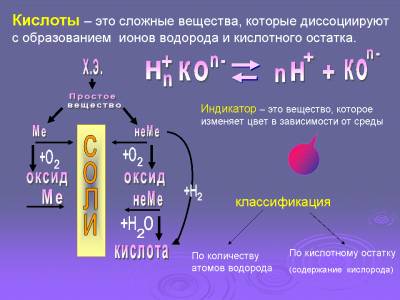 Кислотам можно дать следующее определение: Кислота - это сложное вещество, при диссоциации которого образуются ионы водорода и кислотного остатка. *** В настоящее время наиболее распространены три теории кислоты и оснований. Они не противоречат друг другу, а дополняют: · по теории сольвосистем, начало которой положили работы американских химиков Кэди и Франклина, опубликованные в 1896—1905 гг., кислота — такое соединение, которое даёт в растворе те положительные ионы, которые образуются при собственной диссоциации растворителя (Н3О+, NH4+). Это определение хорошо тем, что не привязано к водным растворам; · по протонной теория кислот и оснований, выдвинутой в 1923 г. независимо датским учёным Йоханнесом Брёнстедом и английским учёным Томасом Лоури, кислоты — водородсодержащие вещества, отдающие при реакциях положительные ионы водорода — протоны. Слабость этой теории в том, что она не включает в себя не содержащие водорода вещества, проявляющие кислотные свойства, так называемые апротонные кислоты; · по электронной теории, предложенной в 1923 г. американским физикохимиком Гилбертом Льюисом, кислота — вещество, принимающее электронные пары, т. е. акцептор электронных пар.. Таким образом, в теории Гилберта Льюиса кислотой могут быть как молекула, так и катион, обладающие низкой по энергии свободной молекулярной орбиталью; · Пирсон модифицировал теорию Льюиса с учётом характеристик орбиталей-акцепторов, введя понятие жёстких и мягких кислот и оснований (принцип Пирсона или принцип ЖМКО). Жёсткие кислоты характеризуются высокой электроотрицательностью и низкой поляризуемостью атома, несущего свободную орбиталь, мягкие кислоты, соответственно, характеризуются низкой электроотрицательностью и высокой поляризуемостью атома, несущего свободную орбиталь. Следует также отметить, что многие вещества проявляют амфотерные свойства, то есть ведут себя как кислоты в реакциях с основаниями и как основания — в реакциях с более сильной кислотой. (со страниц Википедии***) Кислоты классифицируют по таким признакам: а) по наличию или отсутствию кислорода в молекуле и б) по числу атомов водорода. По первому признаку кислоты делятся на кислородсодержащие и бескислородные (табл.). Классификация кислот по составу.
По количеству атомов водорода, способных замещаться на металл, все кислоты делятся на одноосновные (с одним атомом водорода), двухосновные (с 2 атомами Н) и трехосновные (с 3 атомами Н), как показано в табл. Классификация кислот по числу атомов водорода. Одноосновные Двухосновные Трехосновные HNO3 азотная H2SO4 серная H3PO4 фосфорная HF фтороводородная H2SO3 сернистая HCl хлороводородная H2S сероводородная HBr бромоводородная H2CO3 угольная HI иодоводородная H2SiO3 кремниевая ** Термин “одноосновная кислота” возник потому, что для нейтрализации одной молекулы такой кислоты требуется “одно основание”, т.е. одна молекула какого-либо простейшего основания типа NaOH или KOH: HNO3 + NaOH = NaNO3 + H2O Двухосновная кислота требует для своей нейтрализации уже “два основания”, а трехосновная - “три основания”: H3PO4 + 3 NaOH = Na3PO4 + 3 H2O Номенклатура кислот: Если кислородосодержащая кислота содержит неметалл в максимальной степени окисления, совпадающей с номером группы, то ее название производится от названия неметалла с прибавления окончания - вая, -ная. По мере понижения степени окисления неметалла суффиксы в названиях кислот изменяются в следующем порядке: -оватая, -истая, -оватистая. Например: хлорная HClO4, хлорноватая HClO3, хлористая HClO2, хлорноватистая HClO. Если кислота не содержит кислород, то к названию неметалла добавляют суффикс -о- и окончание -водородная. Например, сероводородная H2S. Подробнее о свойствах
| |||||
| Категория: 8 класс | Добавил: himekoscho | Автор: Борисович И.В. | |||||
| Просмотров: 5357 | Загрузок: 0 | Рейтинг: 0.0/0 | |||||
| Всего комментариев: 0 | |


