химэко
Меню сайта
Поиск
Друзья сайта
Наш опрос
Статистика

| Главная » Статьи » Уроки » 9 класс |
|
Актуализация урока: Урок начинается с эвристической беседы. —Что такое скорость реакции? Прежде чем школьники
дадут ответ на этот вопрос, нужно с ними
обсудить, что мы понимаем под понятием скорость. Они из физики знают о скорости перемещения тела в пространстве. Однако
общее понятие скорости у них не
сформировано. Нужно подвести их к тому, что скорость — это изменение какой-либо физической величины во времени. Для
этого обсуждаем примеры скоростей различных процессов (слайд 1). —
Что
собой представляет скорость механического движения? Дети говорят, —Когда нам показывают кино, то через киноаппарат
прокручивают кинопленку с определенной скоростью. Как можно измерить эту
скорость? Сообщаем, что —При анализе крови определяют такой фактор, как СОЭ — скорость
оседания Каждый раз подчеркиваем, что скорость процесса — это изменение какой-либо физической величины за единицу времени. Теперь
нам нужно найти величину, которая изменяется в химической реакции. Вспомним,
как осуществляется химическая реакция. Школьники вспоминают, что она
осуществляется при столкновении частиц. Очевидно, чем чаще сталкиваются частицы, тем выше скорость реакции. Отчего зависит частота столкновения частиц?
Приходим к понятию Концентрация. —Какое определение можно дать скорости реакции? Надо выслушать все —
Какую
величину мы примем изменяющейся во времени в химической реакции? С=С1 –С2 Нужно вспомнить, что количество вещества, отнесенное к единице объема, есть концентрация. Разумеется, что необходимо активизировать знания ребят о концентрации. Вспоминаем, что концентрация — это количество вещества в единице объема. Она называется молярной и вычисляется по формуле Вспомним, что размерность молярной концентрации — моль/л. Чтобы рассчитать скорость реакции в растворах, нужно изменение концентрации разделить на интервал времени. — Как выразить разность концентраций исходных веществ? —Можно ли измерять скорость реакции по
изменению концентрации продуктов — Какова размерность скорости реакции? 'Школьники должны вывести из формулы размерность скорости реакции: моль/л-с (слайды 2,3). Также следует обсудить вероятность достижения нулевой концентрации исходных веществ. Проделаем опыт №1, показывающий зависимость скорости реакции от природы вещества. ( Инструкция к опыту: В пробирки с цинком, алюминием, медью прилейте 1-2 мл разбавленной серной кислоты. Отметьте внешние признаки реакции в пробирке с цинком и алюминием. Что вы наблюдаете в пробирке с медью? Обратите внимание на скорость реакции в первых двух пробирках. Попробуйте объяснить, в чем причина различия скорости проделанных вами реакций.) Вводим понятие константы скорости реакции. Под химической природой вещества мы будем понимать его состав, тип и прочность химических связей такой реакции. На опыте показываем, что различные реакции по-разному протекают во времени. В чем заключается разница в процессе протекания этих двух реакций? Ребята отмечают, что реакция соляной кислоты с цинком протекает очень быстро, а с железом происходит долго. Делаем вывод, что реакции отличаются по скоростям протекания. Решаем в группах задачу 2(Б). —
А как изменить концентрацию газообразного
вещества? Дети должны понять, что концентрация газа изменяется в зависимости от давления: при
повышении давления
концентрация увеличивается, при понижении — уменьшается. Делаем вывод, что изменение давления газообразного вещества будет
изменять скорость реакции. —
Можно
ли изменить скорость реакции твердого вещества? Дети вспоминают Таким образом, дети убеждаются, что на скорость реакции можно влиять. Поясняем, что влияние на скорость реакции имеет для нас большое значение. В промышленности требуется увеличивать скорость реакции, чтобы сделать химическое производство рентабельным (выгодным). Нежелательные реакции требуется замедлить. Например, ржавление железа — реакция, которая приносит потерю металла. Такую реакцию требуется замедлить. Поэтому мы должны знать, от каких факторов зависит скорость реакции. Рассмотрим влияние температуры на скорость реакции в четыре этапа: 1.
Экспериментальное
исследование зависимости скорости реакции от температуры. 2.
Введение
температурного коэффициента и его расчет. 3.
Выявление
сущности влияния температуры на скорость реакции. 4. Закрепление
усвоения нового материала в ходе решения задач. Температурный коэффициент показывает, во сколько раз возрастает скорость реакции при повышении температуры на 10 градусов. Эксперимент показал, что температурный коэффициент колеблется в пределах от 2 до 4 раз. Теперь нам нужно обсудить, почему температура влияет на скорость реакции. —Что мы делаем с веществом, повышая его температуру? - Нагреваем, то есть —Для чего требуется энергия? Куда она расходуется? Нужно
подвести ребят к —Как осуществляется связывание атомов? - С помощью
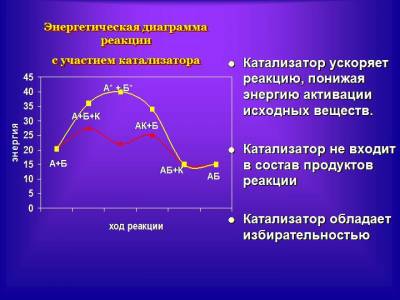
общей электронной пары. Покажем на рисунке, как изменяется электронная плотность на примере взаимодействия иода с водородом (см. учебник, рис. 25). Когда молекулы столкнулись, то атомы водорода и иода разных молекул также начинают связываться общими электронами. Образуется общее электронное облако для четырех атомов. Оно неустойчиво и меняется: электронная плотность из области между атомами иода и атомами водорода как бы перетекает в область между двумя атомами водорода и двумя атомами иода. Возникает промежуточное состояние, образованное двумя молекулами. Его называют активированным комплексом. Такой комплекс распадается на две новые молекулы. На рисунке видим, что для образования комплекса нужно столкновение молекул. На это требуется энергия. Энергия нужна, чтобы химические связи внутри столкнувшихся молекул нарушились. Эту энергию называют энергией активации. Ее относят к 1 моль вещества. Изобразим процесс возникновения активного комплекса на диаграмме. Дадим определение энергии активации: энергия активации — это энергия, которую необходимо сообщить частицам вещества в количестве 1 моль для образования активированных комплексов. Таким образом, большим скоростям реакций препятствует энергетический барьер в виде энергии активации. Можно ли преодолеть этот барьер? Рассмотрим действие катализатора (слайд 6,7). Заслушаем также небольшое сообщение о действии ферментов в организме человека. рассмотрим на схеме, как действует катализатор на энергию активации реагентов. Дети получают опорные конспекты, в которых отражена зависимость скорости реакции от различных факторов. Затем переходим к ответам на вопросы самоконтроля (слайды), которые помогают выявить наиболее трудноусваиваемые моменты. Рефлексия: Подводя итоги урока ученики обобщают полученную информацию, закрепляют формулировки, оценивают свою деятельность. Учитель в заключительном слове дает оценку успешности урока в целом и отдельных учеников в частности, задает домашнее задание.
| |
| Категория: 9 класс | Добавил: himekoscho (15.11.2009) | |
| Просмотров: 9722 | Рейтинг: 5.0/1 |
| Всего комментариев: 0 | |